납축전지(차량용배터리 ; battery)
1 납축전지 개요
1) 축전지 개요
- 2차 전지로, 전기에너지를 화학에너지로 저장하고 전기에너지화 할 수 있는 장치.
2) 납축전지 충전과 방전
- 방전시 전해액의 산성성분은 양극과 반응하여 감소한다.
* H2O가 생성되고 전해액 비중은 낮아짐. 이 비율로 방전량과 잔여기전력을 확인할 수 있다.
- 충전시 양극판에서 산성분이 환원되기 때문에 전해액 비중은 증가한다.
* 환원전극 (+극): PbO2(s) + HSO−4(aq) + 3H+(aq) + 2e− → PbSO4(s) + 2H2O(l)
* 산화전극 (-극): Pb(s) + HSO−4(aq) → PbSO4(s) + H+(aq) + 2e−
- 아래의 전체 반응에 따라 방전이 이루어져 납 전극 및 이산화납 전극의 황산 납 전극으로 전환된다.
* Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
3) 축전지 용량표시
- 용량(Ah) = 방전전류(A) x 방전시간(h)
- 20시간율
* 일정방전전류를 연속방전하여 셀당 방전 전압이 1.75V 될때까지 20시간 방전시킬 수 있는 전류의 총량
* 100AH 용량은 5A 의 전류로 연속방전하여 방전 전압에 이를때까지 20시간이 소요된다는 의미

2 사용간 주의사항
1) 과방전
- 과방전시 PbO2가 환원이 어려운 PbSO4로 변환되어 충전효율이 떨어진다.
- 과방전시 전해액의 비중이 떨어지고 작용물질이 격리판에 고착되어 충전이 불가능하게 된다.
- 축전지가 과방전되면 한랭시 동파된다.
※ 완전방전[20℃] : 비중 1.18 전압 1.75V
2) 과충전
- 전해액의 물을 분해시켜 수소/산소가스를 만드는데 이것은 극판의 화학적 효율을 저하시킨다.
- 수분을 증발시켜 산도를 높이며 이로인해 격리판을 약하게 만든다.
※ 완전충전[20℃] : 비중 1.38 전압 2.2V
3) 정전류 충전
- 충전중에는 전해액의 온도가 45℃ 이상 상승되지 않도록 해야함.
- 여러 축전기 충전시 직류로 연결하여 충전.
- 용량이 다른 축전지를 동시에 충전할 경우 전류는 가장 작은 축전지 기준으로 충전한다.
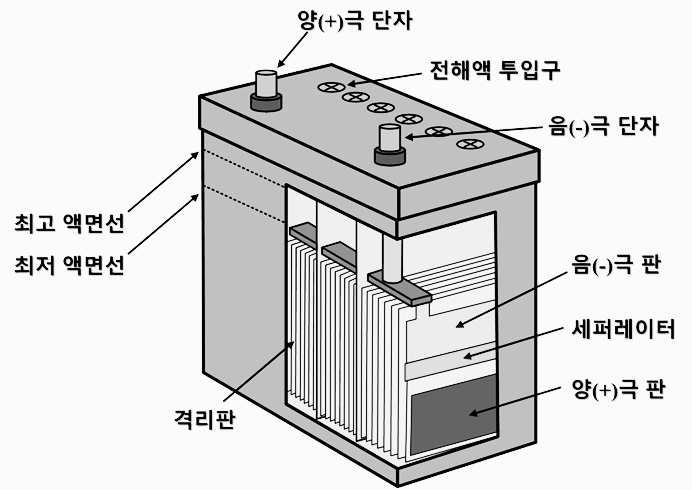
3 축전지의 구조
1) 케이스(container)
- 합성수지 또는 에보나이트 등으로 제작
- 극판과 전해액을 보관하는 케이스
- 12V용은 6개의 Cell로 나누어져 있다.
2) 격리판
- 양극판과 음극판 사이에 끼워져 단락되는것을 방지한다.
* 단락되면 전기에너지 소실
3) 극판
- 음극판 양극판 두가지가 있으며 순연(Pb)과 안티몬(Sb) 합금으로 제작됨.
- 양극판에는 이산화연, 음극판에는 산화연이 도포됨.
4) 전해액
- 황산을 증류수로 희석시킨 무색무취의 묽은황산
- 극판과 접촉하여 셀내부 전류전도작용과 전류를 발생, 저장역할도 함.